Bagian selanjutnya tentang termokimia yang paling utama, adalah perhitungan menentukan perubahan entalpi (дH).. nah kalau bermanfaat ambil dan sebarkan....
PERHITUNGAN PERUBAHAN ENTALPI (Д H)
a. RUMUS UMUM
yang dimaksud rumus umum adalah penentuan perubahan entalpi (Д H) jika memenuhi beberapa kondisi :
n
Q = kalor reaksi (biasanya dalam soal disebut juga dengan perubahan entalpi)
n = mol
b. HUKUM HESS
bunyinya : setiap reaksi mempunyai perubahan entalpi yang tetap, dan tidak bergantung pada mekanisme reaksi atau jumlah tahapan reaksi.
sederhananya kayak pribahasa banyak jalan menuju roma ( mau lewat manapun sampainya tetap diroma (Д H)
Soal yang berkaitan dengan Hukum Hess ada beberapa tipe :
1. Tipe diagram
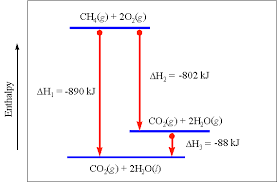
misalkan yang ditanya adalah дH2 maka dapat dicari :
дH2 = дH1 - дH3 = -890 - (-88) =-802 kJ
дH3 bernilai negatif karena berbeda arah tanda panah dari data.
2. Tipe gambar
masih berlanjut.....
PERHITUNGAN PERUBAHAN ENTALPI (Д H)
a. RUMUS UMUM
yang dimaksud rumus umum adalah penentuan perubahan entalpi (Д H) jika memenuhi beberapa kondisi :
- jika dalam soal terdapat keterangan massa (gram)
- jika dalam soal terdapat keterangan volume gas/larutan. kalau gas biasanya STP
n
Q = kalor reaksi (biasanya dalam soal disebut juga dengan perubahan entalpi)
n = mol
b. HUKUM HESS
bunyinya : setiap reaksi mempunyai perubahan entalpi yang tetap, dan tidak bergantung pada mekanisme reaksi atau jumlah tahapan reaksi.
sederhananya kayak pribahasa banyak jalan menuju roma ( mau lewat manapun sampainya tetap diroma (Д H)
Soal yang berkaitan dengan Hukum Hess ada beberapa tipe :
1. Tipe diagram
misalkan yang ditanya adalah дH2 maka dapat dicari :
дH2 = дH1 - дH3 = -890 - (-88) =-802 kJ
дH3 bernilai negatif karena berbeda arah tanda panah dari data.
2. Tipe gambar
masih berlanjut.....

No comments:
Post a Comment
dimohon komentar yang layak